W społeczeństwach wielu krajów, szczególnie o wysokim poziomie cywilizacji, nader często występuje przykra dolegliwość, wymagająca skutecznego i bezpiecznego leczenia – zaparcie. Problem należy do poważnych, na co wskazuje ogromne zużycie leków przeczyszczających. Tylko w roku 1982 w USA pacjenci wydali 368 milionów dolarów [!] na laxantia, z czego 25% były to leki o działaniu stymulującym, w polskim piśmiennictwie zwane drażniącymi.
Do surowców leczniczych stosowanych w zaparciach należą
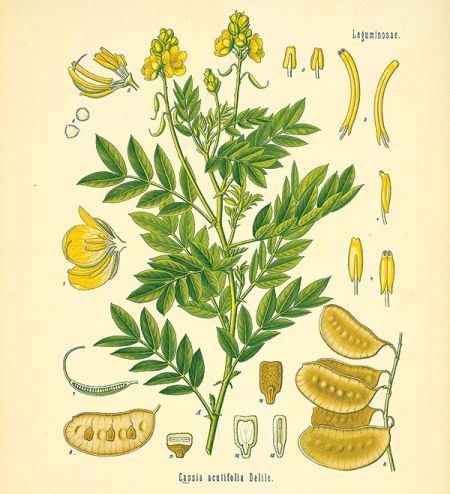
listek i strąk senesu
Oba te surowce, zwane popularnie senesem lub senną, otrzymywane są z dwóch gatunków strączyńców, należących do rodziny Ceasalpiniaceae (brezylkowatych) – strączyńca wąskolistnego Cassia angustifolia Vahl. i strączyńca ostrolistnego Cassia acutifolia Delile o nazwie synonimicznej Cassia senna L.
Strączyniec wąskolistny
występuje w stanie naturalnym na zachodnim wybrzeżu Afryki, w Arabii oraz w Indiach. Od początku XIX w. jest powszechnie uprawiany w południowych i północnych Indiach. Surowce otrzymywane z tego gatunku eksportowane są zwykle przez Bombaj, dlatego nazwane są senesem indyjskim lub bombajskim, czasem także Tinevelly, od nazwy miejscowości w Indiach, w okolicach której prowadzi się na dużych obszarach uprawy senesu.
Strączyniec ostrolistny
rośnie dziko w Egipcie, Sudanie i w północnej Afryce. Eksportowany jest przeważnie przez Aleksandrię, dlatego nazywany bywa senesem aleksandryjskim.
Sana
Oba gatunki strączyńców to dość podobne, niewielkie (1-1,5 m wysokości) półkrzewy, zdrewniałe tylko w części dolnej, o parzystych-pierzastodzielnych 4-8 parach listków i o zebranych w grona żółtych, grzbiecistych kwiatach z jednym słupkiem o jednokomorowej zalążni, z której powstaje płaski, pergaminowaty strąk o 6-8 nasionach.
Lekarze czasów starożytnych nie znali tego surowca. Spotykana w pismach Dioskuridesa nazwa cassia odnosi się do cynamonu, a nie do senesu. Strączyniec jako środek przeczyszczający został wprowadzony do lecznictwa w wiekach X-XI przez Arabów, którzy nazywali go sanna albo sana, od czego powstały popularne dziś nazwy senna lub senes. Początkowo stosowano owoce, dopiero później zaczęto używać liści jako tańszej namiastki. Był to głównie surowiec egipski, wywożony przez Aleksandrię.
W pierwszej farmakopei polskiej Pharmacopea Regni Poloniae (1817) były opisane Folia Sennae que ex Alexandra advehuntur. Dopiero gdy sułtan egipski Mohammed Ali zmonopolizował handel senesem egipskim i podniósł jego cenę, zaczęto od roku 1813 uprawiać strączyniec wąskolistny w Indiach. Senes egipski stracił swe dominujące znaczenie.
Chemizm i działanie
Działanie przeczyszczające Sennae folium i Sennae fructus warunkują antranoidy, wśród których dominują diantrony (75-80%): sennozydy A, A1 i B oraz występujące w mniejszej ilości sennozydy C i D. Pozostałe 20-25% zespołu stanowią antrony.
Dzięki licznym badaniom prowadzonym od lat 30. XX w., mechanizm działania przeczyszczającego związków drażniących został dobrze poznany. Diantronowe sennozydy, pod wpływem enzymów flory bakteryjnej jelita grubego, są metabolizowane do monoantronów oraz wolnych aglikonów – sennidyn. Końcowym produktem degradacji jest reino-9-antron. To ta pochodna działa przeczyszczająco. Konieczność uwolnienia aglikonów i działanie w dolnym odcinku przewodu pokarmowego powoduje, że efekt terapeutyczny występuje dopiero po 8 do 12 godz. po zażyciu.
W działaniu przeczyszczającym sennozydów istotną rolę pełni mikroflora jelita grubego. Stwierdzono to w badaniach na zwierzętach z normalną florą jelitową, u których powstawały aktywne metabolity sennozydów i powodowały biegunkę. W przypadku zwierząt GF (nie posiadających flory jelitowej) nie powstawały produkty degradacji sennozydów i podawanie senny nie wywoływało biegunki.
Działanie przeczyszczające antranoidów polega na zwiększaniu wydzielania wody i elektrolitów przez błonę śluzową do światła jelita grubego i hamowaniu resorpcji zwrotnej wody. Prowadzi to do zwiększenia objętości płynu w jelicie grubym. Wynika też z nasilania motoryki jelita grubego. Stymulacja zakończeń nerwów czuciowych pobudza skurcze podłużne okrężnicy i hamuje skurcze segmentowe zwalniające pasaż. Powoduje to przyspieszenie przesuwania treści pokarmowej i efekt przeczyszczający.
Są więc sennozydy rodzajem pro-leków, które wykazują aktywność farmakologiczną dopiero po dostaniu się do jelita grubego i degradacji przez enzymy bakteryjne do aktywnego metabolitu reinoantronu.
Bezpieczeństwo stosowania
Cząsteczki sennozydów są wysoce hydrofilne i z tego powodu oraz dzięki dużej masie cząsteczkowej nie są wchłaniane w wyższych częściach przewodu pokarmowego. Ulegają degradacji dopiero w dolnych partiach tego układu. Zmniejsza to możliwość absorpcji antranoidów do krwioobiegu.
W badaniach na zwierzętach wykazano, że po podaniu per os toksyczność ostra sennozydów jest niska. Znacznie wyższa jest ich toksyczność po podaniu dożylnym. Po podaniu wielokrotnym per os także nie stwierdzano szkodliwego działania senesu. Stosowanie preparatów senny i jej związków czynnych u zwierząt doświadczalnych przez dłuższy czas, nawet w dawkach wielokrotnie przekraczających dawki zalecane dla ludzi, nie powodowało trwałych negatywnych skutków. W jednym z badań przez 13 tygodni podawano szczurom senes w ilości 300, 750 lub 1500 mg na kilogram, czego efektem były zmiany histopatologiczne w nerkach i odkładanie pigmentu w jelicie grubym. Po 8 tygodniach od odstawienia leku większość zmian cofnęła się.
Stosowanie listków senesu przez okres 11 tygodni u myszy, w dawce odpowiadającej 10 mg sennozydów A i B na kg m.c. – 50 razy przekraczającej dawki stosowane u ludzi, nie powodowało objawów toksycznych.
Genotoksyczność
W badaniach in vitro stwierdzono działanie genotoksyczne antranoidów, występujących w Sennae folium i Sennae fructus; emodyny, reiny i aloe-emodyny, ale po zastosowaniu dawek znacznie przekraczających poziom, w jakim aloe-emodyna występuje w osoczu ludzi (<0,5 ng/ml), po przyjęciu leków z senny. Badania in vitro aktywności genotoksycznej antranoidów dawały wyniki często rozbieżne, natomiast metodami in vivo nie stwierdzono istotnego działania genotoksycznego senny i jej związków czynnych.
Wpływ na karcynogenezę
Zdolność powodowania ogniskowych zmian w kryptach błony śluzowej jelita grubego, uważanych za stan przednowotworowy, stosowana jest do oceny aktywności karcynogennej w jelicie grubym. Wykonano szereg badań dotyczących wpływu sennozydów na śluzówkę jelita grubego, których wyniki wskazywały, że senna może być promotorem karcynogenezy tylko w przypadkach stosowania bardzo wysokich dawek i równoległego działania silnych karcynogenów.
W opublikowanej w roku 2005 pracy wykazano, że dawki senny 30 mg/kg i 60 mg/kg, stosowane u szczurów zdrowych przez 110 tygodni, nie powodowały zwiększenia ilości ogniskowych zmian w kryptach błony śluzowej jelita grubego i przypadków nowotworów, natomiast u szczurów traktowanych azoksymetanem podawanie senny znacząco zwiększało powstawanie zmian w kryptach i ognisk nowotworowych.
Interakcje
Farmakologiczny efekt stosowania antranoidowych leków przeczyszczających – defekacja w wyniku przyspieszenia tranzytu treści pokarmowej przez jelito grube – w znacznym stopniu zmniejsza absorpcję równolegle przyjmowanych leków stosowanych doustnie.
Mechanizm działania przeczyszczającego senny prowadzi przy dłuższym stosowaniu do obniżenia poziomu elektrolitów, szczególnie potasu, co może zaburzać rytm serca i nasilać działanie glikozydów nasercowych. Obniżenie poziomu potasu wpływa negatywnie na efekty działania leków antyarytmicznych, np. chinidyny. Stosowanie łącznie z senesem leków obniżających poziom potasu – diuretyków, adrenokortykosteroidów i korzenia lukrecji – może prowadzić do poważnych zaburzeń elektrolitowych.
Badania kliniczne
Już w jednym z pierwszych dostępnych w piśmiennictwie badań klinicznych, opublikowanych w roku 1957, stwierdzono skuteczność preparatów senny. Efekt terapeutyczny był wyższy w przypadku preparatu o większej zawartości sennozydów, ale nie u wszystkich pacjentów obserwowano tę zależność. Okazało się, że różni pacjenci różnie reagują na średnie i wysokie dawki, co wskazywało na istotną rolę osobniczej wrażliwości na efekt działania senny.
Poważnym problemem terapeutycznym jest zaparcie występujące u pacjentów w stanie terminalnym, szczególnie często u przyjmujących opioidy. W randomizowanym, otwartym badaniu z udziałem 91 pacjentów z terminalną chorobą nowotworową, przyjmujących opioidy, senna i laktuloza wykazały podobną skuteczność, prawie nie powodując działań niepożądanych. W kolejnym badaniu klinicznym, z udziałem prawie pięciuset pacjentów przygotowywanych do operacji jelit lub usunięcia odbytu z powodu nowotworu, porównywano skuteczność senny i glikolu polietylenowego w oczyszczeniu jelit przed planowaną operacją. Senna okazała się bardziej skuteczna, a tolerancja obu leków była zbliżona. Chroniczne zaparcie jest powszechną dolegliwością u pacjentów w starszym wieku, występuje u ponad 40% pacjentów w domach opieki i równie często u pacjentów przebywających przez długi czas w szpitalach. Senes, w połączeniu z nasionami babki jajowatej, w preparacie Agiolax okazał się i w tych przypadkach skutecznym lekiem.
U 30 pacjentów, których przeciętny wiek wynosił 81,8 lat, stwierdzono lepszy efekt terapeutyczny Agiolaxu w porównaniu z laktulozą, bez znaczących działań niepożądanych. Podobnie większą skuteczność Agiolaxu wykazano w wieloośrodkowym badaniu z udziałem 77 pacjentów o średnim wieku 82,9 lat.
Senes jest lekiem skutecznym i bezpiecznym – jeśli jest stosowana zgodnie z zaleceniami, we właściwej i zgodnej z osobniczą wrażliwością dawce, okazjonalnie i nie dłużej niż na kilka dni.
Większość opisywanych w starszych pracach działań niepożądanych wynikało z nieznajomości farmakologicznych właściwości sennesu i z długotrwałego nadużywania zawierających ten surowiec preparatów.
Melanosis coli
Polega na ciemnobrązowym zabarwieniu śluzówki jelita grubego, którego intensywność nasila się w odbytnicy. Występuje u 12-31% pacjentów. Przyjmowanie sennozydów przez okres 4-13 miesięcy powodowało Melanosis coli u wszystkich pacjentów, a u zwierząt doświadczalnych obserwowano zmiany pigmentowe już po 10 dniach podawania fenoloftaleiny i diantronu. Podstawą Melanosis jest pigment, prawdopodobnie lipofuscyna, powstająca w wyniku toksycznego wpływu antranoidów na komórki nabłonka okrężnicy.
Uszkodzenie systemu nerwowego
i osłabienie funkcji jelita Długotrwałe stosowanie leków przeczyszczających o działaniu drażniącym może prowadzić do patologicznych zmian w neuronach “myenteric plexus” i mięśniach gładkich w jelicie grubym.
Może to powodować osłabienie jego funkcji. W badaniach in vitro nie stwierdzono zmniejszenia spontanicznej kurczliwości jelita szczurów w wyniku przewlekłego podawania sennozydów. Z obserwacji wynika jednak, że niektórzy pacjenci, cierpiący na zaparcia, muszą zwiększać dawkę środków przeczyszczających, aby osiągnąć oczekiwany skutek.
* * *
Sennozydy ze względu na mechanizm działania, mogą powodować kurcze i bóle brzucha. Te objawy niepożądane należą do najczęściej zgłaszanych przez pacjentów, jednak nie występują częściej niż w przypadkach stosowania innych leków przeczyszczających.
Senna i zawierające ją produkty lecznicze od dziesiątków lat stanowią grupę cennych leków przeczyszczających, do stosowania w zaparciach. Leków bezpiecznych i o znanej skuteczności leczniczej.
Zawdzięczamy to lekarzom z Arabii, jeszcze z czasów średniowiecza…
Piśmiennictwo: Agra Y., Sacristan A., Gonzalez M. Efficacy of senna versus lactulose in terminal cancer patients treated with opiods. J. of Pain and Symptom Management 15(1)/1998, 1-7; Ahmed S., Gunaratman N. Melanosis coli. New England J. of Medicine 349/2003, 14; al-Dakan AA, al-Tuffail M., Hannan M.A. Cassia senna inhibits mutagenic activites of benzo?pyrene, aflatoxin B1, shamma and methyl methansulfonate. Pharmacol Toxicol. 77(4)/1995, 288-92; Beuers U., Spengler U. Hepatitis after chronic abuse of senna. Lancet. 337/1992, 372-373; Borelli F., Capasso R., Aviello G., Carlo G.D., Izzo A.A., Masolo N. Senna and the formation of aberrant crypt foci and tumors in rats treated with azoxymethane. Phytomedicine, 12/2005, 501-505; Bruneton J. Pharmacognosy, Phytochemistry Medicinal Plants. Lavoisier, Paris, London, New York 1999; Dressen M., Eysen H., Lemli J. The metabolism sennosides A and B by the intestinal microflora: in vcitro and in vivo studies on the rat and the mouse. J. Pharm. Pharmacol. 33/1981, 679-681; ESCOP Monographs. Thieme, Stuttgart 2003; Fugh-Berman A. Herbdrug interactions. Lancet 355/2000, 134-138; Gattuso J., Kamm M. Adverse effects of drugs used in the management of constipation and diarrhea. Drug Safety.10(1)/1994, ; Heidemann A., Miltenburger H.G., Mengs U. The genotoxicity status of Senna. Pharmacology 47(suppl. 1)/1993,178-186; Leng-Peschlow E. Inhibition of intestinal ware and electrolyte absorption by senna derivatives in rats. J. Pharm. Pharmacol. 32/1980, 330-335; Leng-Peschlow E. Modes action of Senna. Pharmacology (Suppl. 1)/1992, 16-19; Leng-Peschlow E. Effects of sennosides A+B and bisacodyl on rat large intestine. Pharmacology 38/1989, 310-18; Leng-Peschlow E. Acceleration of large intestine transit time in rats by sennosides and related compounds. J. Pharm. Pharmacol. 38/1986, 369-273; Leng-Peschlow E. Site of senna action. Pharmacology (Suppl)/ 1992, 10-14; Lüllmann H., Mohr K., Ziegler A., Bieger D. Kieszonkowy atlas farmakologii. PZWL, Wwa 1995; Kinunen O., Windbland I., Koistinen P. Safety and efficacy of a bulk laxative containing senna versus lactulose in the treatment of chronic constipation in geriatric patients. Pharmacology. 47/1993, 253-55; Kostowski W. Farmakologia. PZWL, Wwa 1997; Marvola M., Koponen A., Hiltunen R., Hieltala P. The effect of raw material purity on the acute toxicity and laxative effect of sennosides. J. Pharm. Pharmacol. 33/1981, 108-109; Mascolo N., Mereto E., Borelli F., Orsi P. Does Senna extract promote growth of aberrant crypt foci and malignant tumors in rat colon? Di.Dis. Sci. 44(11)/1999, 2226-30; abstract wg. Pub. Med. PMID:10573366; McClure Browne J.C., Edmunds V., Fairbairn J.W., Reid D.D. Clinical and laboratory assessment of senna preparations. British Medical Journal. 1957, 436-439; Mengs U., Mitchell J., McPherson S., Gregson R. A 13 week oral toxicity study of Senna in the rat with an 8-week recovery period. Arch. Toxicol.78/2004, 269-275; Müller-Lissner S. Adverse effects of laxatives: Fact and fiction. Pharmacology 47(suppl.1)/1993, 138-145; Passmore A., Wilson Davies K., Flanagan P.G. A comparison of Agiolax and Lactulose in elderly patients with chronic constipation. Pharmacology. 47(suppl. 1), 249-252; Ramkumar D., Rao S. Efficacy and safety of traditional medical therapies for chronic constipation:systematic review. American J. of Gastroenterology 100/2005, 936-971; Seybold U., Landauer N., Hillebrand S. Senna - induced hepatitis in a poor metabolizer. Annals of Internal Medicine 141 (8)/2004, 650-651; Valverde A., Hay J.M., Fingrhut A., Boudet M.J., Petroni R., Pouliquen X. Senna vs polyethylene glycol for mechanical preparation the evening before elective colonic or rectal resection. Arch. Surg. 134/1999, 514-519; de Witte P., Lemli L. The metabolizm of anthranoid laxatives. Hepato- gastroenterol. 37/1990, 601-605; de Witte P. Metabolism and pharmacokinetics of anthranoids. Pharmacology 47 (suppl. 1)/1993, 86-97; Xing J., Soffer E. Adverse effects of laxatives. Dis. Colon Rectum. 44(8)/2001, 1201-1209.