Johanna Signer, Hulda R. Jonsdottir1, Werner C. Albrich, Marc Strasser, Roland Züst, Sarah Ryter, Rahel Ackermann-Gäumann, Nicole Lenz, Denise Siegrist, Andreas Suter, Roland Schoop i Olivier B. Engler
Artykuł opublikowany pierwotnie na stronie Virology Journal, https://virologyj.biomedcentral.com/articles/10.1186/s12985-020-01401-2
Licencja: Creative Commons Attribution 4.0 International License, http://creativecommons.org/licenses/by/4.0/
Tłumaczenie artykułu: Szymon Pawełek
Streszczenie
Kontekst: Przez długi czas uważano, że koronawirusy (CoV) wiążą się wyłącznie z łagodnymi objawami w ludzkim układzie oddechowym i pokarmowym, jednak nagły wzrost przypadków bliskowschodniego zespołu niewydolności oddechowej (MERS)-CoV, ciężkiego ostrego zespołu niewydolności oddechowej (SARS)-CoV-1 oraz niedawno rozpoznanego SARS-CoV-2 utwierdził ich odzwierzęcy potencjał i zdolność powodowania poważnej zapadalności, przy czym wskaźnik śmiertelności wynosi od 4 do 35%. Obecnie nie ma żadnej dostępnej profilaktyki ani leczenia dla zakażeń koronawirusami. Zbadaliśmy zatem wirusobójczy i przeciwwirusowy potencjał jeżówki purpurowej Echinacea purpurea (Echinaforce®) przeciwko ludzkiemu koronawirusowi (HCoV) 229E, wysoce patogennym MERS- i SARS-CoV, a także nowo rozpoznanemu SARS-CoV-2 w warunkach in vitro.
Metody: W celu określenia przeciwwirusowego potencjału ekstraktu wstępnie poddaliśmy jego działaniu cząsteczki i komórki wirusowe, a następnie oceniliśmy resztkową zakaźność metodą granicznych rozcieńczeń. Co więcej, poddaliśmy komórki działaniu ekstraktu po zakażeniu w celu dalszego ocenienia potencjału jego wykorzystania w profilaktyce przeciw koronawirusom i w ich leczeniu. Określiliśmy również działanie ochronne Echinaforce® w zrekonstruowanym nabłonku nosowym.
Wyniki: W trakcie niniejszego badania stwierdziliśmy, że HCoV-229E został nieodwracalnie inaktywowany po wystawieniu na działanie preparatu Echinaforce® w stężeniu 3,2 μg/ml IC50. Wstępne zastosowanie preparatu na liniach komórkowych nie zahamowało jednak zakażenia HCoV-229E, a zastosowanie po zakażeniu wywarło nieznaczne działanie na propagację wirusa przy stężeniu 50 μg/ml. Zaobserwowaliśmy natomiast działanie ochronne w organotypowej hodowli komórek na skutek poddania nabłonka oddechowego działaniu kropli H-CoV-229E, co imitowało naturalne zakażenie. Stwierdzone działanie wirusobójcze preparatu Echinaforce® nie ograniczało się do koronawirusów powodujących przeziębienie, jako że zarówno SARS-CoV-1, jak i MERS-CoV zostały inaktywowane przy porównywalnych stężeniach. Ostatecznie SARS-CoV-2, będący patogenem COVID-19, również został inaktywowany po zastosowaniu preparatu Echinaforce® w stężeniu 50μg/ml
Wnioski: Wyniki ukazują, iż Echinaforce® ma działanie wirusobójcze przeciwko HCoV-229E przy bezpośrednim kontakcie i w organotypowym modelu hodowli komórkowej. Ponadto MERS-CoV, a także SARS-CoV-1 oraz SARS-CoV-2 zostały inaktywowane przy podobnych stężeniach ekstraktu. Naszą hipotezą jest zatem, iż preparaty na bazie Echinacea purpurea, takie jak Echinaforce®, mogą być skutecznymi środkami profilaktycznymi przeciw wszystkim koronawirusom ze względu na ich podobną strukturę.
Słowa kluczowe: Przeciwwirusowe, Echinacea, koronawirus, prewencja, HCoV-229E, Przeziębienie, SARS-CoV-1, MERS-CoV, SARS-CoV-2
Kontekst
Koronawirusy (CoV) to otoczkowe, jednoniciowe wirusy RNA z dużym genomem o dodatniej polarności, zwykle o długości 26-32 kpz. Należą do rodziny Coronaviridae i są zdolne do zakażania wielu różnych nosicieli [1]. Niegdyś uważano, że koronawirusy zdolne do wywoływania choroby u ludzi (HCoV) objawiają się wyłącznie łagodnymi dolegliwościami układu pokarmowego i oddechowego. Obecnie znanych jest siedem wirusów HCoV. Cztery z nich, tj. HCoV-229E, HCoV-OC43, HCoV-NL63 i HCoV-HKU1, nie są odzwierzęce i powodują globalne wzrosty infekcji górnych dróg oddechowych (IGDO) głównie w okresie zimowym [2]. Uznaje się, iż te powszechnie występujące wirusy są odpowiedzialne za 10-15% wszystkich takich infekcji u ludzi. Replikują się one w nosogardzieli i przeważnie powodują łagodne, samoograniczające się IGDO o krótkich okresach inkubacji, jednakże występowały również przypadki infekcji dolnych dróg oddechowych i zapalenia płuc [3–6]. Do momentu, w którym po raz pierwszy zdiagnozowano przypadek ciężkiego ostrego zespołu niewydolności oddechowej (SARS)-CoV-1 w roku 2002, uważano, że wirusy HCoV wywołują głównie przeziębienie. Jednak bardziej zjadliwe koronawirusy, bliskowschodni zespół niewydolności oddechowej (MERS)-CoV i SARS-CoV-1, posiadają zwierzęce rezerwuary, za których źródło uznaje się nietoperze [7], a także potrafią wywoływać ciężkie zapalenie płuc z dłuższym okresem inkubacji, często ze skutkiem śmiertelnym [8]. Ludzkość po raz pierwszy zetknęła się z SARS-CoV-1 w 2002 r., co spowodowało globalną pandemię, która w szczycie wynosiła 8422 zakażeń i 916 zgonów [9]. MERS-CoV jest endemiczny wśród wielbłądów dromaderów i prowadzi do infekcji dolnych dróg oddechowych u ludzi, przy czym aktualna śmiertelność wynosi 35% [10]. W 2019 r. doszło do nagłego wzrostu przypadków zapalenia płuc spowodowanego nowym koronawirusem, zwanym SARS-CoV-2, który pochodził podobno z targu owoców morza w chińskim Wuhan. W wyniku wybuchła globalna pandemia z 25 milionami zakażeń i ponad 800 000 zgonów (raport WHO, 31 sierpnia 2020 i [11]). Na chwilę obecną brak jest potwierdzonych i przetestowanych klinicznie środków przeciwwirusowych przeznaczonych do leczenia koronawirusów w ogóle, a także odzwierzęcych betakoronawirusów, co jest szczególnie niepokojące [12]. Biorąc pod uwagę rosnącą liczbę przypadków i ich dotkliwość, znalezienie niedrogiego, dostępnego i skutecznego leku przeciwko ludzkim koronawirusom jest sprawą najwyższej wagi.
Jeżówka (Echinacea) w krajach Ameryki Północnej była tradycyjnym środkiem wykorzystywanym w zapobieganiu i leczeniu objawów przeziębienia i grypy, a obecnie należy do najczęściej stosowanych roślin leczniczych w Ameryce Północnej oraz Europie [13]. Na rynku dostępnych jest kilka różnych produktów, odmiennych nie tylko ze względu użyty gatunek Echinacea i części rośliny, ale także ze względu na proces wytwarzania, co niestety wpływa na duży rozdźwięk w jakości i działaniu [14, 15]. Echinaforce® jest standaryzowanym preparatem na bazie ekstraktu ze świeżo zebranej jeżówki purpurowej (Echinacea purpurea) i roztworu o zawartości alkoholu 65%.
Stosowanie preparatu Echinaforce® jako środka zapobiegawczego i leczniczego w infekcjach dróg oddechowych było tematem badań przedklinicznych i klinicznych, w toku których udokumentowano jego korzystne działanie [16–19]. Szczególny mechanizm działania nie jest w pełni jasny, jednak badania in vitro wskazują, że Echinaforce® hamuje rozwój otoczkowych wirusów w drogach oddechowych, w tym grypy typu A oraz B, syncytialnego wirusa oddechowego (RSV) czy wirusa paragrypy, poprzez bezpośredni kontakt z całymi wirionami i otoczkami białkowymi wirusów [20, 21]. Zasadniczo działanie wewnątrzkomórkowe jeżówki Echinacea stwierdzono w przypadku niektórych wirusów (np. grypy i wirusa opryszczki zwykłej), ale nie wszystkich (np. RSV) i wyłącznie przy stężeniach wyższych niż te wymagane dla zewnątrzkomórkowej inaktywacji. Co więcej, wykazano, że Echinacea wpływa na zależne od wirusa wydzielanie cytokin [22, 23]. Jako że typowe objawy przeziębienia, tj. kichanie, kaszel i katar, wynikają ze stymulacji cytokin prozapalnych, ograniczenie wydzielania cytokin może pomóc w łagodzeniu podobnych objawów. Randomizowane, multicentryczne badanie kliniczne typu non-inferiority z podwójnie ślepą próbą wykazało, że Echinaforce® jest nie mniej skuteczny niż oseltamiwir u pacjentów z chorobą grypopodobną, tj. obejmującą dolne drogi oddechowe (kaszel) i objawy ogólne (np. ból głowy, ból mięśni, gorączka), a także z potwierdzonym zakażeniem grypą, przy czym powikłania były nieznacznie rzadsze po zastosowaniu Echinaforce Hot Drink® w porównaniu do oseltamiwiru [17].
Przeciwwirusowe działanie jeżówki Echinacea było badane w warunkach in vitro na większości wirusów wywołujących infekcje układu oddechowego, wiążących się z przeziębieniem i grypą, ale jak dotąd nie na koronawirusach. Jako że HCoV-229E stanowi przykładowy szczep koronawirusa powodujący sezonowe przeziębienie, użyliśmy tego szczepu do zbadania ogólnego przeciwwirusowego działania Echinaforce® przeciwko koronawirusom, czym uzupełniliśmy braki w wiedzy o przeciwwirusowych właściwościach jeżówki purpurowej (Echinacea purpurea) w przypadkach wirusowych przeziębień. Ponadto poszerzyliśmy obszar analizy o pozostałe koronawirusy, tj. MERS-CoV, SARS- CoV-1 i SARS-CoV-2. Dodatkowo użyliśmy organotypowej hodowli komórek nabłonka oddechowego (MucilAir™) pochodzącego z nosa do zbadania działania ochronnego Echinaforce® przeciwko HCoV-229E w hodowli, która ściśle naśladuje żywy nabłonek oddechowy człowieka. W tym badaniu zaobserwowaliśmy nieodwracalne obniżenie zakaźności czterech koronawirusów w wyniku bezpośredniego kontaktu z ekstraktem. Stwierdzono także działanie ochronne po wstępnym zastosowaniu preparatu w części szczytowej organotypowego modelu układu oddechowego.
Dodatkowo w celu głębszego zbadania wirusobójczego działania Echinaforce® wirusy z innych rodzin, zarówno te otoczkowe, jak i bezotoczkowe, zostały poddane działaniu genomów RNA lub DNA. Ze względu na zaobserwowaną podatność różnych koronawirusów spodziewaliśmy się, iż pozostałe wirusy otoczkowe również zostaną inaktywowane przez ekstrakt. Jednakże z uwagi na fakt, iż wirusy bezotoczkowe są zwykle odporniejsze, a Echinaforce® prawdopodobnie wywiera działanie wirusobójcze bezpośrednio na membranę wirusa, spodziewaliśmy się, że podobne wirusy będą bardziej odporne na leczenie. Co ciekawe, wirus żółtej gorączki, otoczkowy wirus RNA, został łatwo inaktywowany przez Echinaforce®, w przeciwieństwie do wirusa krowianki, otoczkowego wirusa DNA.
Metody
Preparat na bazie jeżówki Echinacea
Echinaforce® (A. Vogel AG, Roggwil, Szwajcaria – dalej zwany Echinaforce) składa się z ekstraktu hydroetanolowego (65% v/v etanolu) ze świeżo zebranej jeżówki purpurowej (Echinacea purpurea) wytworzonego zgodnie z Dobrą Praktyką Produkcyjną (GMP). Ziele i korzeń jeżówki są ekstrahowane oddzielnie przy pomocy roztworu o zawartości etanolu 65%, przy czym pod uwagę brany jest stosunek lek-ekstrakt DER 1:11 oraz 1:12. Następnie obie części są łączone, co daje ostateczny stosunek 95:5. Skład typowych markerów w testowanej serii 1,023,117 widnieje w Tabeli 1. Końcowe stężenie etanolu w ekstrakcie wynosiło 65% v/v z 16 mg/ml suchej masy jeżówki. Eksperymenty przeprowadzono przy użyciu standaryzowanego płynnego preparatu uzyskanego bezpośrednio od firmy A. Vogel AG. Ten sam preparat jest dostępny na rynku.
| Mieszanina | Stężenie (μg/ml) |
| Kwas kawowy | 0 ± 0 |
| Kwas kaftarynowy | 264,4 ± 13,0 |
| Kwas chlorogenowy | 40,2 ± 2,0 |
| Kwas cychorowy | 313,8 ± 0 |
| Cynarin | 0 ± 0 |
| Echinakozyd | 6,9 ± 0,4 |
| PID 8/9 | 41,4 ± 0,2 |
Linie komórkowe i wirusy
Linie komórkowe i wirusy wykorzystane w tym badaniu zostały opisane kolejno w Tabelach 2 i3.
Zrekonstruowany w warunkach in vitro ludzki nabłonek oddechowy (MucilAir™)
Zrekonstruowany ludzki nabłonek oddechowy (MucilAir™) pochodzący z komórek nabłonkowych z nosa kupiono od firmy Epithelix Sàrl, Genewa, Szwajcaria. Komórki od trzech różnych zdrowych dawców były użyte w każdym eksperymencie w celu uwzględnienia zmienności między dawcami. Eksperymenty zostały przeprowadzone czterokrotnie, po dwa razy każdy. W trakcie badania podłoże do hodowli (MucilAir™, 500 μl/24-dołkowe) było wymieniane co 2-3 dni, natomiast strona szczytowa była delikatnie myta (2-4 razy) przy użyciu 200 μl podłoża w celu usunięcia resztkowej wydzieliny [26].
Toksyczność komórek
Toksyczność komórek określono poprzez poddanie komórek Huh-7, Vero i Vero E6 działaniu serii rozcieńczeń Echinaforce i zmierzenie żywotności komórek testem MTT (Vybrant® MTT Cell Proliferation Assay Kit, ThermoFisher, Rheinach, Szwajcaria) oraz Alamar Blue™ (Thermo Fisher, Reinach, Szwajcaria) zgodnie z instrukcją producenta. Na potrzeby testu MTT preparat Echinaforce rozcieńczono w odpowiadającym podłożu do 100, 50, 20, 10, 1 i 0 μg/ml, a następnie dodano do komórek Huh-7 lub Vero w 80-procentowej konfluencji na 96-dołkowych płytkach (200 μl/dołek). Komórki przykryto folią uszczelniającą i inkubowano w temperaturze 33°C kolejno przez 5 i 7 dni dla komórek Huh-7 i Vero. Na potrzeby analizy do każdego dołka dodano świeże podłoże (200 μl/dołek) oraz 10 μl roztworu podstawowego MTT, a komórki następnie inkubowano przez 4 godziny w temperaturze 37°C. Po inkubacji do każdego dołka dodano 100 μl SDS 10% rozcieńczonych w 0,01 M HCl (Merck Millipore, Molsheim, Francja) i inkubowano przez 18 godzin w temperaturze 37°C. Poziom absorbancji zmierzono fotometrem (Spectra- Max Plus, Bucher Biotec, Bazylea, Szwajcaria) w 570 nm. Na potrzeby testu Alamar Blue preparat Echinaforce rozcieńczono w odpowiadającym podłożu do 100, 50, 20, 10, 1 i 0 μg/ml, a następnie dodano do komórek Vero E6 w 80-procentowej konfluencji na 24-dołkowych płytkach (500 μl/dołek) i inkubowano przez 24 godziny w temperaturze 37°C. Do podłoża hodowli dodano odczynnik 10% v/v Alamar Blue™ i inkubowano przez następne 24 godziny. Następnie absorbancja została zmierzona czytnikiem płytek GloMax™ (Promega, Dübendorf, Szwajcaria) w 570 nm z referencyjną długością fal na poziomie 600 nm.
| Nazwa | Gatunek | Tkanka | Średnie | Pozyskane z |
| Huh-7 | Człowiek | Wątroba | DMEM + 10% FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Prof. Volker Thiel, Uniwersytet w Bernie, Szwajcaria |
| Vero (CRL 81 TM) | Afrykańska Zielona Małpa | Nerka | MEM + 10% FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | ATCC (Manassas, Wirginia, 20110 USA) |
| Vero E6 (C1008) | Afrykańska Zielona Małpa | Nerka | MEM + 10% FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | ATCC (Manassas, Wirginia, 20110 USA) |
| A9 (85011426) | Mysz | Areolowa tkanka tłuszczowa | DMEM + 10% FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | ECACC (Zdrowie Publiczne Anglia, Salisbury, Wielka Brytania) |
Wszystkie komórki hodowano w 37°C bez CO2
*Dulbecco’s Modified Eagle Medium (DMEM), Minimum Essential Medium (MEM), Fetal Bovine Serum (FBS), Penicillin/Streptomycin (Pen/Strep, 100 U/mL)
| Nazwa | Napięcie | Propagowane w | Średnie* | Pozyskane z |
| HCoV | 229E | Huh-7, 33 °C | DMEM+ 5%FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Prof. Volker Thiel, Uniwersytet w Bernie, Szwajcaria [24, 25] |
| MERS-CoV | EMC | Vero, 37 °C | DMEM+ 5%FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Prof. Volker Thiel, Uniwersytet w Bernie, Szwajcaria [24, 25] |
| SARS-CoV | Frankfurt-1 | Vero, 37 °C | DMEM+ 5%FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Prof. Volker Thiel, Uniwersytet w Bernie, Szwajcaria [24, 25] |
| SARS-CoV-2 | BetaCoV/Francja/IDF0372/2020 | Vero E6, 37 °C | DMEM+ 5%FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Instytut Pasteura, Paryż, Francja za pośrednictwem EVAg, European Virus Archive. |
| Parwowirus myszy | Prototyp MVM, ATCC-1346 | A9, 37 °C | DMEM+ 5%FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Narodowa Kolekcja Wirusów Patogennych, Wielka Brytania |
| Wirus żółtej febry | 17D, NCPV-0507 | Vero, 37 °C | DMEM+ 5%FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Narodowa Kolekcja Wirusów Patogennych, Wielka Brytania |
| Wirus krowianki | Elstree (szczepionka Lister), ATCC-VR-1549 | Vero, 37 °C | DMEM+ 5%FBS, 2 mM glutamina, aminokwasy endogenne, Pen/strep, HEPES (Biochrom, Niemcy) | Narodowa Kolekcja Wirusów Patogennych, Wielka Brytania |
Wszystkie komórki hodowano w 37°C bez CO2
*Dulbecco’s Modified Eagle Medium (DMEM), Minimum Essential Medium (MEM), Fetal Bovine Serum (FBS), Penicillin/Streptomycin (Pen/Strep, 100 U/mL)
Wirusobójcze i przeciwwirusowe działanie przeciwko HCoV-229E w hodowlach komórek
Wstępne zastosowanie na cząsteczkach wirusowych
4× 104 TCID50/ml HCoV-229E inkubowano z preparatem Echinaforce rozcieńczonym do 0, 2, 5, 10, 20, 40, 500 i 100 μg/ml w roztworze DMEM z 2% FBS, inkubowanym przez 1 godzinę w temperaturze pokojowej na wytrząsarce. W celu określenia resztkowej zakaźności poddane działaniu roztwory wirusów zostały przemyte czterokrotnie za pomocą 15-17 ml płynu buforowego (1:100 PBS, pH 7.4, w dH2O, Biochrom, Niemcy) i przepuszczone przez filtr Vivaspin® 20 Ultrafiltration Units (Sartorius AG, Getynga, Niemcy) w ilości 800 g przez 15 minut. Wirusy zostały wydobyte z urządzenia filtrującego przy użyciu bufora glicynowego (3750 mg/l glicyny, 10 g/l ekstraktu wołowego, 14.6 g/l NaCl, pH 9.5, Sigma-Aldrich, Niemcy) i rozcieńczone w stosunku 1:10 w podłożu DMEM z 5% FBS. Resztkowa zakaźność wirusów została określona za pomocą metody granicznych rozcieńczeń (TCID50) zgodnie z metodą Spearmana-Kärbera [27].
Wstępne zastosowanie na komórkach
Komórki Huh-7 były inkubowane z preparatem Echinaforce w stężeniu 0, 1, 10 lub 50 μg/ml w podłożu dla hodowli przez trzy dni w temperaturze 33°C. Następnie podłoże zawierające Echinaforce zostało usunięte, a komórki były infekowane przy użyciu 100 TCID50 HCoV-229E (MOI na poziomie 0.005) przez 1 godzinę w temperaturze 33°C. Podłoże wymieniono, a komórki w dalszym ciągu inkubowano przez 48 godzin w temperaturze 33°C, z kolei miano wirusa w nadsączu zostało określone przy użyciu metody granicznych rozcieńczeń.
Zastosowanie na komórkach po zakażeniu
Komórki Huh-7 infekowano 100 TCID50 HCoV-229E (MOI na poziomie 0.005) przez 1 godzinę w temperaturze 33°C, a po dwukrotnym przemyciu komórek kompletnym podłożem dodano podłoże o zawartości 0, 1, 10 lub 50 μg preparatu Echinaforce/ml. Komórki inkubowano w temperaturze 33°C przez 72 godziny, a miano wirusa w nadsączu zostało określone 24 i 72 godziny po zakażeniu przy użyciu metody granicznych rozcieńczeń.
Wirusobójcze i przeciwwirusowe działanie przeciwko HCoV-229E na redyferencjonowanym nabłonku oddechowym
Przed zastosowaniem usunięto warstwę wydzieliny z powierzchni szczytowej hodowli MucilAir™ (Epithelix Sàrl, Genewa, Szwajcaria) poprzez trzykrotne przemycie za pomocą 200 μl roztworu Hank’s Balanced Salt Solution (HBSS, Cat N° 14,175,095, Thermo Fisher Scientific, Rheinach, Szwajcaria). Następnie nabłonek został poddany działaniu preparatu w części szczytowej poprzez inkubację wkładek ze 100 μl podłoża MucilAir™ zawierającymi preparat Echinaforce w stężeniu 1, 10 lub 50 μg/ml przez 1 godzinę w temperaturze 33°C, po czym usunięto podłoże i ponownie wprowadzono styk fazy ciekłej i powietrza. Następnego dnia do powierzchni szczytowej dodano bufor HBBS zawierający stężenie preparatu Echinaforce 1, 10 lub 50 μg/ml, a następnie w kroplach dodano kolejne 50 μl HBBS zawierającego 100 TCID50 HCoV-229E i inkubowano przez 1 godzinę w temperaturze 33°C. Następnie ponownie wprowadzono styk fazy ciekłej i powietrza, a hodowlę w dalszym ciągu inkubowano w temperaturze 33°C. Nowo powstały wirus został zebrany z powierzchni szczytowej przy użyciu wkładek myjących i 200 μl HBSS 24, 48 i 72 godziny po zakażeniu. Obecność miana wirusa w środku myjącym pobranym z części szczytowej określono za pomocą metody granicznych rozcieńczeń.
Działanie wirusobójcze przeciwko MERS-CoV, SARS-CoV-1, SARS-CoV-2, wirusowi żółtej gorączki, wirusowi krowianki, MVM
W celu ocenienia wirusobójczego działania preparatu Echinaforce przeciwko innym wirusom inkubowaliśmy 1 ml MERS-CoV (5 × 104 PFU/ml), SARS-CoV-1 (2 × 105 PFU/ml), wirusa żółtej gorączki (4 × 105PFU/ml), wirusa krowianki (8 × 104 PFU/ml) i MVM (8 × 104 TCID 50/ml) z preparatem w stężeniu 0, 1, 10 i 50 μg/ml w podłożu do hodowli komórek przez 60 minut w temperaturze pokojowej na wytrząsarce. 450μl SARS-CoV-2 (8.33 × 104 TCID50/ml) było inkubowanych w tych samych stężeniach preparatu Echinaforce przez 60 minut w temperaturze 37°C na wytrząsarce. Resztkową zakaźność określono za pomocą standardowej metody łysinek zastosowanej na komórkach Vero (MERS-CoV, SARS-CoV-1, wirus żółtej gorączki i wirus krowianki) lub metody granicznych rozcieńczeń na komórkach A9 (MVM) lub komórkach Vero E6 (SARS-CoV-2), zgodnie z poniższym opisem.
Oznaczanie wirusów
Metoda dawki zakaźnej dla 50% hodowli tkanek (TCID50)
TCID50 dla HCoV-229E, MVM i SARS-CoV-2 zostało określone dzięki metodzie granicznych rozcieńczeń. W skrócie próbki rozcieńczono w seriach w stosunku 1:10 w podłożu MEM z 2% FBS. Z każdego roztworu 100 μl zaaplikowano do 10 różnych dołków w 96-dołkowej płytce zawierających komórki Huh-7, A9 lub Vero E6 w stanie 80-procentowej konfluencji kolejno dla HCoV-229E, MVM i SARS-CoV-2. Po inkubacji trwającej 7 dni w temperaturze 33°C (HCoV-229E), 13 dni w temperaturze 37°C (MVM) lub 3 dni w temperaturze 37°C (SARS-CoV-2) płytki barwiono fioletem krystalicznym przez 15 minut (1% roztwór wodny, Merck, Zug, Szwajcaria), a TCID50 określono metodą Spearmana-Kärbera [27].
Metoda łysinek
Jednostki tworzące łysinkę (PFU) dla MERS-CoV, SARS-CoV-1, wirusa żółtej gorączki i wirusa krowianki określono za pomocą standardowej metody łysinek. W skrócie rozcieńczane seriami próbki zmiareczkowano na komórkach Vero w stanie konfluencji w 24-dołkowych płytkach, na które nałożono podłoże MEM z 2% FBS zawierające 2% metylocelulozy (90HG 4000 cP, Sigma Aldrich, Szwajcaria), a następnie inkubowano przez 3-5 dni w temperaturze 37°C do momentu, w którym łysinki stały się łatwo zauważalne przy badaniu mikroskopem. Dla wizualizacji płytki barwiono fioletem krystalicznym (1% roztwór wodny, Merck, Zug, Szwajcaria) przez 15 min.
Analiza statystyczna
Dane przeanalizowano jednoczynnikową lub dwuczynnikową analizą wariancji ANOVA wraz z testem Tukeya dla porównania. P <0,05 uznaje się za statystycznie istotne. Wszystkie analizy przeprowadzono przy użyciu programu GraphPad Prism, wersji 8.
Wyniki
Preparat Echinaforce zmniejsza zakaźność HCoV-229E w sposób dawkozależny
W celu określenia bezpośredniego działania wirusobójczego preparatu Echinaforce przeciwko ludzkiemu koronawirusowi 229E 4 × 104 TCID50/ml poddaliśmy działaniu wzrastającym stężeniom ekstraktu, a następnie określiliśmy jego wpływ na zakaźność wirusa za pomocą metody granicznych rozcieńczeń. Kontakt z preparatem Echinaforce trwający 60 minut spowodował dawkozależne zmniejszenie zakaźności HCoV-229E (Wykres 1). Replikacja wirusa zatrzymała się całkowicie przy stężeniu ekstraktu 50-100 μg/ml przy połowie maksymalnego stężenia hamującego (IC50) na poziomie 3,2 μg/ml, podczas gdy równoległa inkubacja komórek z preparatem Echinaforce wykazała stabilną żywotność komórek przy wszystkich sprawdzonych stężeniach (Rys. 1).
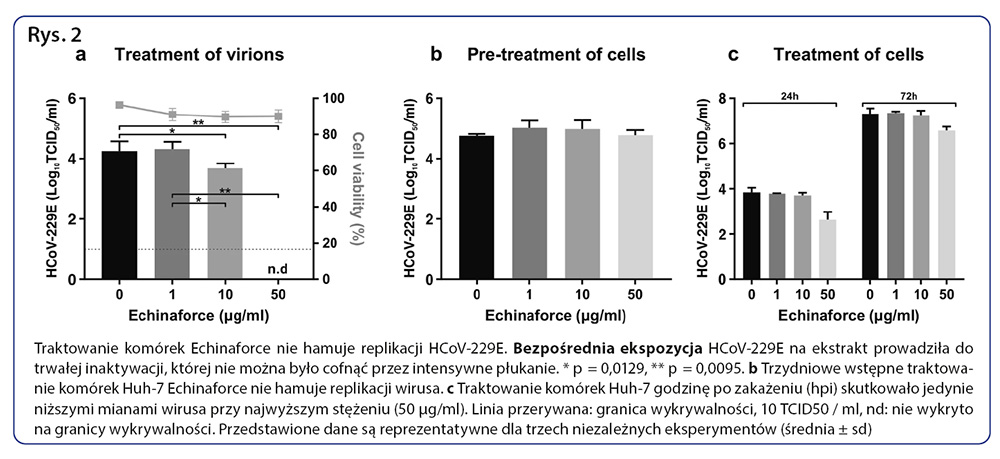
Preparat Echinaforce wpływa na zakaźność poprzez nieodwracalne interakcje z HCoV-229E
Jako że niewiele wiadomo o sposobie działania ekstraktów z jeżówki (Echinacea), zamierzaliśmy stwierdzić, czy Echinaforce działa przeciwwirusowo wyłącznie w oparciu o bezpośredni kontakt z wirionami czy także wewnątrzkomórkowo w trakcie replikacji wirusa. W tym celu preparat Echinaforce stosowano na różnych etapach zakażenia HCoV-229E. Na początku cząsteczki wirusa HCoV-229E wstępnie poddano działaniu preparatu przed zakażeniem. Następnie komórki poddawano działaniu preparatu przez 3 dni przed zakażeniem. Na koniec preparat Echinaforce dodano do komórek 1 godzinę po zakażeniu. Z badań wynika, iż po kontakcie z ekstraktem nastąpiło stałe zmniejszenie zakaźności wirusa, ponieważ działanie wirusobójcze nie mogło zostać odwrócone poprzez ekstensywne mycie wirusa (Wykres 2a). Z kolei wstępne poddanie działaniu preparatu nie wywarło żadnego wpływu na zakaźność lub replikację HCoV-229E (Wykres 2b). W komórkach poddanych działaniu preparatu po zakażeniu doszło do niewielkiej redukcji miana wirusa przy najwyższej dawce 50 μg/ml (Wykres 2c).
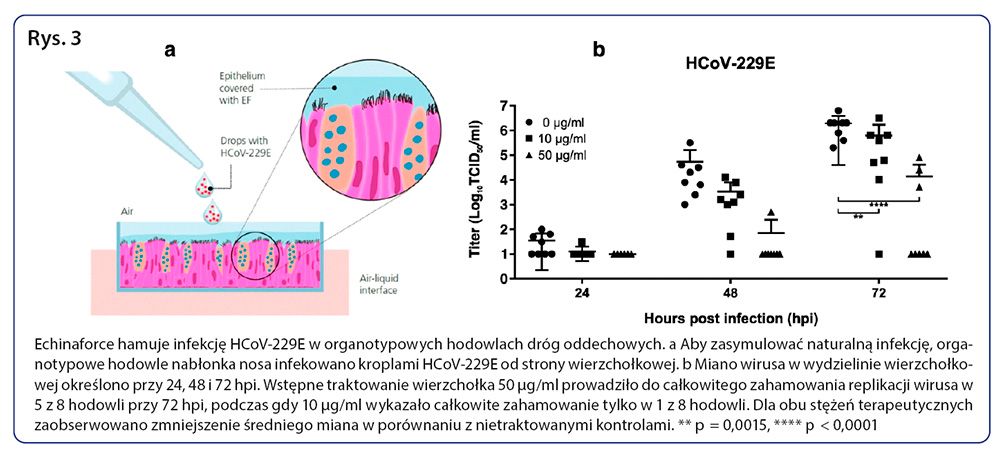
Echinaforce hamuje zakażenie HCoV-229E w komórkach nabłonka oddechowego
Aby określić, na czym polegałoby przeciwwirusowe działanie preparatu Echinaforce w bardziej naturalnych warunkach, wykorzystaliśmy redyferencjonowany, pseudostratyfikowany model hodowli komórek nabłonka oddechowego. Zrekonstruowany nabłonek funkcjonuje, wydziela śluz i wykazuje czynne bicie rzęsek i klirens śluzowo-rzęskowy, bardzo podobnie do żywego nabłonka. W celu symulacji codziennego stosowania ekstraktu część szczytową hodowli poddano działaniu preparatu Echinaforce w ilości 0, 10, i 50 μg/ml przez 1 dzień. Następnie zawiesinę z wirusem, zawierającą 100 TCID50 HCoV-229E, naniesiono w kroplach na powierzchnię szczytową nabłonka, co symulowało kontakt i przenoszenie wirusa przeziębienia (Wykres 3a). Replikację wirusa oceniano 24, 48 i 72 godziny po zakażeniu poprzez oznaczanie zakaźnego wirusa w wydzielinie z powierzchni szczytowej. W nabłonku oddechowym niepoddanym działaniu preparatu (0 μg/ml) HCoV-229E sprawnie się replikował. Rozwój wirusa można było zauważyć już 24 godziny po zakażeniu, a miana wirusa zwiększyły się w ciągu 72 godzin do mediany wynoszącej 2 × 106 TCID50/ml. W nabłonku oddechowym wstępnie poddanym działaniu stężenia preparatu 50 μg/ml miana wirusa pozostawały poniżej poziomu detekcji w 7 z 8 hodowli 48 godzin po zakażeniu i w 5 z 8 hodowli 72 godzin po zakażeniu (Wykres 3b). Gdy wirus nie był całkowicie unieszkodliwiony (3/8), wzrost miana wirusa zaczynał się później i ostatecznie obejmował miana, które pozostały na poziomie o 2-3 log niższym od mian kontrolnych 72 godziny po zakażeniu, co wskazuje na działanie ochronne przy braku całkowitej inaktywacji (p< 0,0001). Jako że preparat Echinaforce jest obecny po stronie szczytowej nabłonka, działanie to wynika najpewniej z inaktywacji inokulum lub nowo powstałego wirusa, co poskutkowało brakiem zakażenia lub jego opóźnieniem. Wstępne poddanie nabłonka oddechowego działaniu stężenia preparatu Echinaforce 10 μg/ml było mniej skuteczne; mimo wszystko poskutkowało opóźnieniem rozwoju wirusa i zmniejszeniem mian wirusa w porównaniu do próbek kontrolnych niepoddanych wstępnemu działaniu preparatu (p = 0,002), ale całkowite zahamowanie rozwoju wirusa nastąpiło tylko w 1 z 8 hodowli.
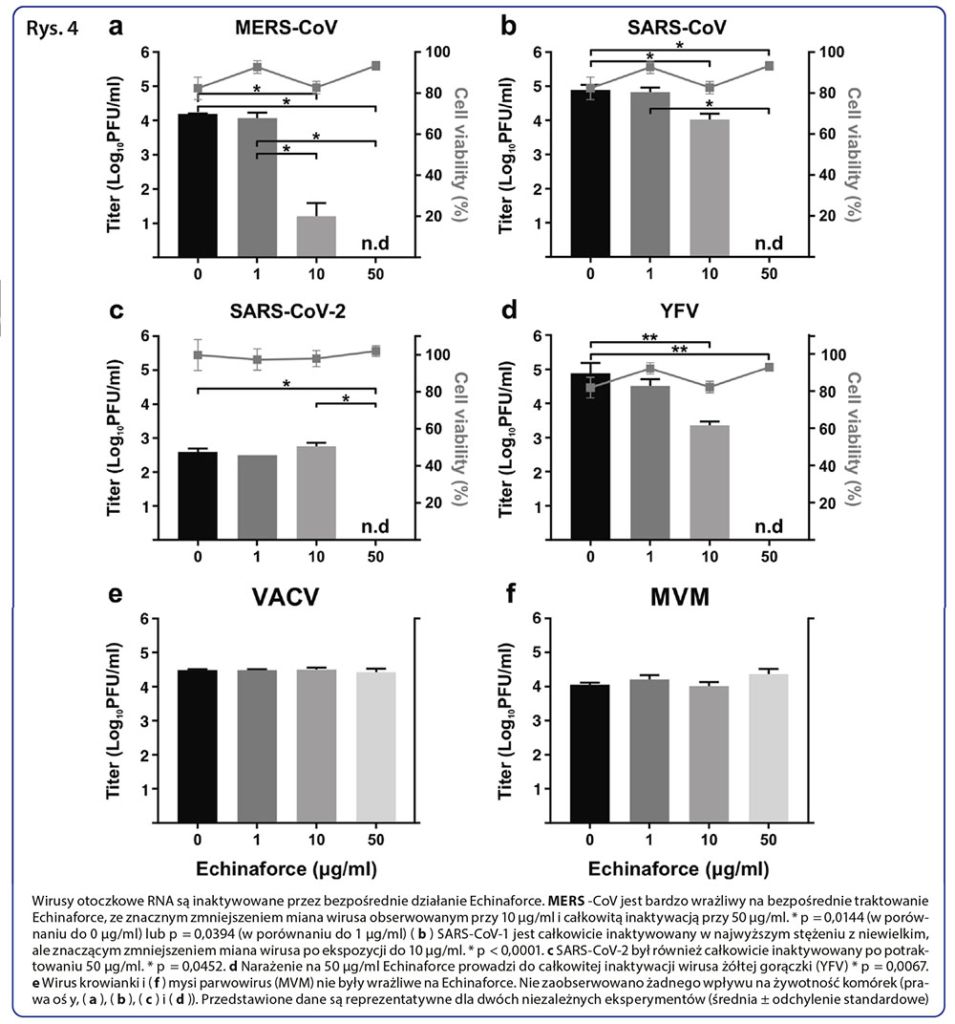
Preparat Echinaforce wykazuje działanie wirusobójcze przeciwko otoczkowym wirusom RNA, w tym SARS-CoV-1 i SARS-CoV-2
Jako iż preparaty z jeżówki Echinacea wykazały działanie wirusobójcze i przeciwwirusowe wobec HCoV-229E i innych otoczkowych wirusów powodujących infekcje układu oddechowego [13, 28], spodziewaliśmy się podobnego działania w przypadku pokrewnych, wysoce chorobotwórczych koronawirusów MERS-CoV i SARS-CoV-1. W tym celu oceniliśmy działanie wirusobójcze preparatu Echinaforce przeciwko tym wirusom. Stwierdzone działanie przeciwko MERS-CoV (Wykres 4a) i SARS-CoV-1 (Wykres 4b) było porównywalne do działania zaobserwowanego na HCoV-229E, przy czym całkowita inaktywacja nastąpiła po zastosowaniu 50 μg/ml. Co ciekawe, MERS-CoV okazał się jeszcze podatniejszy na działanie niższego stężenia (10 μg/ml) preparatu Echinaforce (p = 0.0144) niż HCoV-229E. Inaktywacja nowo rozpoznanego SARS-CoV-2 przebiegła podobnie do SARS-CoV-1, przy czym całkowita inaktywacja nastąpiła przy stężeniu 50μg/ml (Wykres 4c, p = 0.0452). Podobne działanie wirusobójcze stwierdzono w przypadku wirusa żółtej gorączki (YFV), innego wirusa RNA (Wykres 4d). Natomiast preparat Echinaforce nie wykazał żadnego wpływu na zakaźność wirusa krowianki (VACV, Wykres 4e) i drobnego wirusa myszy (MVM, Wykres 4f), będącymi kolejno otoczkowymi i bezotoczkowymi wirusami DNA.
Omówienie
Produkty lecznicze o szerokim działaniu przeciwwirusowym są niezwykle ważne dla medycyny, jako że zbyt wyspecjalizowane leki polegają na szybkim i dokładnym rozpoznaniu patogenu i mogą być niezdolne do atakowania wariantów genetycznych nowo powstałych wirusów [29]. Z uwagi na wysoką liczbę wirusów potrafiących wywoływać infekcje układu oddechowego oraz tempo, w jakim objawy mogą się rozwijać, łatwo dostępne leki o wszechstronnym działaniu mogłyby być wysoce pożądane dla celów profilaktycznych i leczniczych w przypadku chorób układu oddechowego. Jednakże dla większości wirusów powodujących infekcje układu oddechowego nie ma dostępnej właściwej terapii [30–32]. Skuteczne leki przeciwwirusowe o szerokim zastosowaniu zmniejszyłyby dotkliwość i przenoszenie choroby, tym samym ograniczając ogólną dolegliwość i śmiertelność wspomnianych wirusów [33]. Biorąc pod uwagę tendencje wysoce chorobotwórczych koronawirusów do przenoszenia odzwierzęcego, leki działające przeciw nim cieszą się szczególnym zainteresowaniem, a obecna pandemia SARS-CoV-2 wyraźnie ukazuje zapotrzebowanie na łatwo dostępne leki przeciwwirusowe o szybkim działaniu.
Ziołowe preparaty na bazie jeżówki Echinacea tradycyjnie stosowano w zapobieganiu i leczeniu objawów przeziębienia i grypy, i nadal są one powszechnie używane [10, 13]. Ekstrakt z jeżówki purpurowej (Echinacea purpurea) Echinaforce wykazuje szeroki zakres właściwości hamujących zakaźność grypy typu A i B, wirusa paragrypy i wirusa opryszczki pospolitej w warunkach in vitro, a także wpływa na wydzielanie cytokin wynikające z zakażenia wirusem [20–22]. Wyniki tego badania uzupełniają istniejące już wcześniej ustalenia, wykazując bezpośrednie działanie przeciwwirusowe preparatu Echinaforce, zarówno wobec koronawirusa 229E (HCoV-229E), jak i wysoce chorobotwórczych koronawirusów (SARS-CoV-1 I MERS-CoV). Stwierdziliśmy dawkozależną inaktywację HCoV-229E po bezpośrednim kontakcie z ekstraktem, a 50-procentowe obniżenie zakaźności (IC50) osiągnięto przy stężeniu 3,2 μg/ml. Podobnie jak w przypadku wirusa RSV nie stwierdzono żadnego działania wewnątrzkomórkowego dla HCoV-229E, ponieważ zastosowanie preparatu Echinaforce przed zakażeniem nie miało wpływu na replikację wirusa, co jeszcze dobitniej wykazuje, że dla działania wirusobójczego wymagany jest bezpośredni kontakt z wirusem. Powyższa konstatacja oraz stwierdzenie, iż zastosowanie ekstraktu na hodowlach po zakażeniu ma jedynie ograniczone działanie przy najwyższym stężeniu (50 μg/ml), sugerują, że zaobserwowane działanie przeciwko koronawirusom ogranicza się do faz zewnątrzkomórkowych, tj. etapu przed wejściem wirusa do komórki lub w trakcie uwalniania nowo powstałego wirusa. Ponadto wirusobójcze działanie nie dotyczy pojedynczego szczepu, jako że pokrewne koronawirusy SARS-CoV-1 i 2, a także MERS-CoV były inaktywowane w podobny sposób. Co ciekawe, nawet niezwiązane z nimi wirusy RNA, takie jak wirus żółtej gorączki, były podatne na działanie preparatu Echinaforce, wskazując na jego wszechstronne działanie przeciwwirusowe wobec wirusów otoczkowych.
Mechanizm działania różnych preparatów z jeżówki Echinacea pozostaje dotąd nieznany, jednak dla większości wirusów preparat Echinaforce zdaje się działać przy bezpośrednim kontakcie, co prowadzi do trwałej inaktywacji wirionów. W tym badaniu zahamowania zakaźności HCoV-229E po bezpośrednim kontakcie nie udało się odwrócić poprzez mycie. To działanie wynika najpewniej z ciągłych zmian w komponentach wirusa, możliwe, że w samej otoczce wirusa lub białkach strukturalnych, tj. glikoproteinie S lub białku błonowym M. Mimo iż proponowano swoiste hamowanie dla grypy [20], heterogeniczność białek otoczkowych i receptorów komórkowych używanych przez wszelkie wirusy podatne na działanie jeżówki stanowi argument przeciwko swoistemu mechanizmowi działania. Wszechstronne działanie przeciwwirusowe jeżówki Echinacea wobec różnych otoczkowych wirusów RNA wskazuje raczej na ogólne działanie hamujące. Bezotoczkowe rinowirusy są podatne na wysokie stężenia preparatu Echinaforce, w przeciwieństwie do adenowirusów i parwowirozy myszy [21]. Co ciekawe, jeżówka nie działa hamująco na wirusa krowianki, dużego otoczkowego wirusa DNA. Jest to dotąd jedyny wirus otoczkowy odporny na działanie preparatu Echinaforce.
Zbadaliśmy, czy działanie ochronne w górnych drogach oddechowych mogłoby zostać odtworzone w warunkach in vitro w zrekonstruowanym trójwymiarowym nabłonku oddechowym, tj. w hodowlach na styku fazy ciekłej i powietrza (ALI), gdzie strona szczytowa poddawana jest działaniu powietrza tak jak w ludzkim układzie oddechowym. Hodowla zawiera wiele elementów właściwych dla ludzkiego układu oddechowego, w tym bicie rzęsek i wydzielanie śluzu [34, 35]. Regularne stosowanie preparatu Echinaforce zasymulowano nałożeniem cienkiej warstwy ekstraktu na komórki, co wystarczyło, by zapobiec zakażeniu HCoV-229E w nabłonku oddechowym lub je zmniejszyć. Ochronę przed zakażeniem HCoV-229E stwierdzono w 5 z 8 hodowli nabłonka oddechowego poddanych działaniu preparatu w stężeniu 50 μg/ml po 72 godzinach. Przy niższym stężeniu (10 μg/ml) całkowita ochrona wystąpiła tylko w 1 z 8 hodowli. Dane wyniki są zgodne ze stwierdzeniami dokonanymi w trakcie badań klinicznych, w toku których sprawdzono wpływ preparatu Echinaforce na występowanie zakażenia dróg oddechowych u 755 ochotników. W randomizowanym, kontrolowanym placebo badaniu klinicznym z podwójnie ślepą próbą liczba przeziębień była znacznie niższa wśród ochotników przyjmujących preparat Echinaforce. Podczas gdy w grupie placebo wystąpiło 188 przeziębień, które łącznie trwały 850 dni, w grupie przyjmującej preparat Echinaforce było ich 149, a trwały one łącznie 672 dni. W trakcie trwania całego badania w grupie przyjmującej preparat wykryto 54 zakażenia wirusem, z czego 21 spowodowanych było trzema z czterech powszechnych koronawirusów, 9 przez HCoV-229E, 11 przez HCoV-HKU1 i 1 przez HCoV-OC43. Z kolei w grupie placebo wykryto 74 zakażenia wirusem, z czego 33 spowodowane były koronawirusami, w tym 15 przez HCoV-229E, 17 przez HCoV-HKU1 i 1 przez HCoV-OC43. To samo badanie dowiodło, że ogólne wskaźniki zakażeń otoczkowymi wirusami powodującymi infekcje układu oddechowego (w tym HCoV-229E, HCoV-NL63 i HCoV-OC43) zostały obniżone u dorosłych o około 50% (p = 0.0114) w ciągu 4-miesięcznego profilaktycznego stosowania preparatu Echinaforce [16]. Ponadto podobne wyniki otrzymano niedawno w badaniu pediatrycznym, w którym stwierdzono podobne obniżenie wskaźników zakażeń u 203 dzieci w wieku 4-12 lat (p = 0.0218) po zastosowaniu preparatu Echinaforce (Ogal M, dane niepublikowane).
Powyższe badania wykazują klinicznie istotną ochronę przed koronawirusami poprzez profilaktyczne stosowanie preparatu Echinaforce w dopuszczalnych i bezpiecznych dawkach. Co więcej, w tym badaniu stwierdziliśmy także działanie ochronne przy stężeniach niższych od tych wymaganych do całkowitej inaktywacji, co wskazuje, iż preparat Echinaforce może mieć korzystne działanie nawet przy suboptymalnych stężeniach. W warunkach naturalnych może to wynikać ze stosowania niedostatecznych dawek lub rzadkiego stosowania. Lepsze działanie ochronne można uzyskać, przyjmując wyższe dawki ekstraktu lub stosując Echinaforce w sposób ukierunkowany na drogi oddechowe, np. przez aerozol. Ponadto odizolowanie i stężenie substancji aktywnych obecnych w produktach z jeżówki Echinacea mogłoby poskutkować niższymi dziennymi dawkami i wzmożonym działaniem. Jednakże jakiekolwiek zmiany w obecnych formułach ekstraktów z jeżówki wymagałyby dogłębnych badań nad farmakokinetyką i toksycznością bardziej stężonych substancji.
Jak wspominano wcześniej, oprócz bezpośredniej inaktywacji cząsteczek wirusa Echinacea hamuje także wydzielanie cytokin w trakcie zakażenia wirusem [36]. Nadmierne wydzielanie interleukiny 6 (IL-6) lub IL-8 powiązano z symptomatycznym rozwojem zakażeń wirusowych, a podobne reakcje, tj. burza cytokinowa, są prawdopodobnie odpowiedzialne za wiele objawów przeziębienia takich jak katar, kaszel, kichanie itp. [37]. W trakcie zakażenia pewnymi wirusami podwyższona reakcja immunologiczna może w rzeczywistości przyczynić się do niszczenia nabłonka oddechowego, a nawet może być główną przyczyną objawów przy braku efektu cytopatycznego zależnego od wirusa [38, 39]. W takich przypadkach hamowanie wydzielania cytokin przez preparat Echinaforce może być korzystne, jako że ogranicza szkodę na nabłonku oddechowym wyrządzoną przez układ odpornościowy [14]. Przeważnie koronawirusy wyposażone są w różne mechanizmy, mające za zadanie unikanie układu odpornościowego nosiciela i w rezultacie nie wywołują wyraźnej reakcji cytokinowej we wczesnej fazie zakażenia [40]. Podobnie jest w przypadku, gdy pomimo dotkliwych objawów i patologii płuc wysoce chorobotwórczy MERS-CoV nie wywołuje zdecydowanej reakcji cytokinowej w pierwotnych komórkach nabłonka oddechowego we wczesnej fazie zakażenia. Natomiast później stwierdzono wywołanie prozapalnych cytokin IL-6 i IL-1β, a także chemokiny IL-8 [41]. Mogłoby to wskazywać, iż przeciwzapalne działanie preparatu Echinaforce może być mniej znaczące w przypadku koronawirusów, zwłaszcza ich łagodniejszych odmian. Jednak biorąc pod uwagę, że stosowanie preparatu Echinaforce w stężeniu 50 μg/ml inaktywowało MERS-CoV, SARS-CoV-1 i SARS-CoV-2, wirusobójcze działanie preparatu wciąż może przyczyniać się do mniejszego przenoszenia i łagodniejszych infekcji dzięki obecności mniej zakaźnego wirusa w górnych drogach oddechowych.
Wnioski
W tym badaniu udowodniliśmy, że cztery ludzkie koronawirusy (HCoV-229E, MERS-CoV, SARS-CoV-1 i SARS-CoV-2) zostają inaktywowane za pomocą preparatu Echinaforce w warunkach in vitro, co jeszcze mocniej uzasadnia jego profilaktyczne stosowanie przeciw szerokiej gamie wirusów powodujących infekcje układu oddechowego, w tym poważne choroby płuc lub przeziębienie. Co więcej, wszechstronnie działający środek przeciwwirusowy, dostosowany do długiego stosowania profilaktycznego po kontakcie, mógłby być korzystny dla pracowników służby zdrowia zajmujących się poważnymi zakażeniami koronawirusami i potencjalnie mógłby zmniejszyć przenoszenie i śmiertelność wysoce chorobotwórczych koronawirusów w ogólnej populacji.
Skróty
ALI: styk fazy ciekłej i powietrza; ATCC: Amerykańska Kolekcja Hodowli Komórkowych; CO2: Dwutlenek węgla; CoV: koronawirus; DER: stosunek lek-ekstrakt; DMEM: modyfikowane podłoże Eagle’a Dulbecco; DNA: kwas deoksyrybonukleinowy; FBS: płodowa surowica bydlęca; GMP: Dobre Praktyki Produkcyjne; HBSS: zrównoważony roztwór soli Hanka; HCl: kwas chlorowodorowy; HCoV: ludzki koronawirus; hpi: godziny po zakażeniu; IC50: połowa maksymalnego stężenia hamującego; IL: interleukina; MEM: podłoże Eagle’a; MERS: bliskowschodni zespół niewydolności oddechowej; MVM: drobny wirus myszy; PFU: jednostki tworzące łysinkę; RNA: kwas rybonukleinowy; RSV: syncytialny wirus oddechowy; SARS: ciężki ostry zespół niewydolności oddechowej; SDS: siarczan dodecylu sodu; TCID50: dawka zakaźna dla 50% hodowli komórkowych; IGDO: infekcja górnych dróg oddechowych; VACV: wirus krowianki; YFV: wirus żółtej gorączki
Bibliografia
- Fehr AR, Perlman S. Coronaviruses: an overview of their replication and pathogenesis. Methods Mol Biol. 2015;1282:1–23.
- Elliot AJ, Fleming DM. Common respiratory infections diagnosed in general practice. In: Eccles R, Weber O, editors. Common cold. Basel: Birkhäuser Basel; 2009. p. 47–75.
- Dominguez SR, Robinson CC, Holmes KV. Detection of four human
coronaviruses in respiratory infections in children: a one-year study in
Colorado. J Med Virol. 2009;81(9):1597–604. - Pene F, Merlat A, Vabret A, Rozenberg F, Buzyn A, Dreyfus F, et al.
Coronavirus 229E-related pneumonia in immunocompromised patients. Clin Infect Dis. 2003;37(7):929–32. - Woo PCY, Lau SKP, Chu C-M, Chan K-H, Tsoi H-W, Huang Y, et al.
Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia. J Virol. 2005;79(2):884–95. - Su S, Wong G, Shi W, Liu J, Lai ACK, Zhou J, et al. Epidemiology, genetic recombination, and pathogenesis of coronaviruses. Trends Microbiol. 2016; 24(6):490–502.
- Cui J, Li F, Shi ZL. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol. 2019;17(3):181–92.
- de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14(8):523–34.
- Peiris JS, Guan Y, Yuen KY. Severe acute respiratory syndrome. Nat Med. 2004;10(12 Suppl):S88–97.
- Clarke TC, Black LI, Stussman BJ, et al. Trends in the use of complementary health approaches among adults: United States, 2002–2012. National health statistics reports; no 79. Hyattsville: National Center for Health Statistics; 2015.
- Paules CI, Marston HD, Fauci AS. Coronavirus Infections—More Than Just the Common Cold. JAMA. 2020;323(8):707–8.
- Zumla A, Chan JF, Azhar EI, Hui DS, Yuen KY. Coronaviruses – drug discovery and therapeutic options. Nat Rev Drug Discov. 2016;15(5):327–47.
- Barrett B. Medicinal properties of Echinacea: a critical review.
Phytomedicine. 2003;10(1):66–86. - Vimalanathan S, Schoop R, Suter A, Hudson J. Prevention of influenza virus induced bacterial superinfection by standardized Echinacea purpurea, via regulation of surface receptor expression in human bronchial epithelial cells. Virus Res. 2017;233:51–9.
- Osowski S, Rostock M, Bartsch HH, Massing U. Pharmaceutical comparability of different therapeutic Echinacea preperations. Forschende Komplementarmedizin und klassische Naturheilkunde. 2000;7(6):294–300.
- Jawad M, Schoop R, Suter A, Klein P, Eccles R. Safety and efficacy profile of Echinacea purpurea to prevent common cold episodes: a randomized, double-blind. Placebo-Controlled Trial Evid-Based Complement Alternative Med. 2012;2012:841315.
- Raus K, Pleschka S, Klein P, Schoop R, Fisher P. Effect of an Echinacea-based hot drink versus oseltamivir in influenza treatment: a randomized, doubleblind, double-dummy, multicenter, noninferiority clinical trial. Curr Ther Res Clin Exp. 2015;77:66–72.
- Schapowal A. Efficacy and safety of Echinaforce(R) in respiratory tract infections. Wien Med Wochenschr. 2013;163(3–4):102–5.
- Schapowal A, Klein P, Johnston SL. Echinacea reduces the risk of recurrent respiratory tract infections and complications: a meta-analysis of randomized controlled trials. Adv Ther. 2015;32(3):187–200.
- Pleschka S, Stein M, Schoop R, Hudson JB. Anti-viral properties and mode of action of standardized Echinacea purpurea extract against highly pathogenic avian influenza virus (H5N1, H7N7) and swine-origin H1N1 (S-OIV). Virol J. 2009;6:197. Signer et al. Virology Journal (2020) 17:136 Page 10 of 11
- Sharma M, Anderson SA, Schoop R, Hudson JB. Induction of multiple proinflammatory cytokines by respiratory viruses and reversal by standardized Echinacea, a potent antiviral herbal extract. Antiviral Res. 2009;83(2):165–70.
- Sharma M, Schoop R, Hudson JB. Echinacea as an antiinflammatory agent: the influence of physiologically relevant parameters. Phytotherapy Res. 2009;23(6):863–7.
- Sharma M, Schoop R, Hudson JB. The efficacy of Echinacea in a 3-D tissue model of human airway epithelium. Phytotherapy Res. 2010;24(6):900–4.
- Kindler E, Jonsdottir HR, Muth D, Hamming OJ, Hartmann R, Rodriguez R, et al. Efficient replication of the novel human betacoronavirus EMC on primary human epithelium highlights its zoonotic potential. mBio. 2013;4(1): e00611–2.
- Thiel V, Herold J, Schelle B, Siddell SG. Infectious RNA transcribed in vitro from a cDNA copy of the human coronavirus genome cloned in vaccinia virus. J Gen Virol. 2001;82(Pt 6):1273–81.
- Jonsdottir HR, Dijkman R. Characterization of human coronaviruses on welldifferentiated human airway epithelial cell cultures. Methods Mol Biol. 2015; 1282:73–87.
- Ramakrishnan MA. Determination of 50% endpoint titer using a simple formula. World J Virol. 2016;5(2):85–6.
- Hudson J, Vimalanathan S. Echinacea—a source of potent antivirals for respiratory virus infections. Pharmaceuticals (Basel). 2011;4(7):1019–31.
- Zhu JD, Meng W, Wang XJ, Wang HC. Broad-spectrum antiviral agents. Front Microbiol. 2015;6:517.
- Brendish NJ, Clark TW. Antiviral treatment of severe non-influenza
respiratory virus infection. Curr Opin Infect Dis. 2017;30(6):573–8. - Hayden FG. Advances in antivirals for non-influenza respiratory virus infections. Influenza Other Respi Viruses. 2013;7(s3):36–43.
- Hayden FG. Combination antiviral therapy for respiratory virus infections. Antiviral Res. 1996;29(1):45–8.
- Beigel JH, Nam HH, Adams PL, Krafft A, Ince WL, El-Kamary SS, et al.
Advances in respiratory virus therapeutics – a meeting report from the 6th isirv antiviral group conference. Antiviral Res. 2019;167:45–67. - de Jong PM, van Sterkenburg MA, Hesseling SC, Kempenaar JA, Mulder AA, Mommaas AM, et al. Ciliogenesis in human bronchial epithelial cells cultured at the air-liquid interface. Am J Respir Cell Mol Biol. 1994;10(3):271–7.
- de Jong PM, van Sterkenburg MA, Kempenaar JA, Dijkman JH, Ponec M. Serial culturing of human bronchial epithelial cells derived from biopsies. In Vitro Cell Dev Biol Anim. 1993;29a(5):379–87.
- Guiotto P, Woelkart K, Grabnar I, Voinovich D, Perissutti B, Invernizzi S, et al. Pharmacokinetics and immunomodulatory effects of phytotherapeutic lozenges (bonbons) with Echinacea purpurea extract. Phytomedicine. 2008; 15(8):547–54.
- Doyle WJ, Skoner DP, Gentile D. Nasal cytokines as mediators of illness during the common cold. Curr Allergy Asthma Rep. 2005;5(3):173–81.
- Lee S, Hirohama M, Noguchi M, Nagata K, Kawaguchi A. Influenza a virus infection triggers pyroptosis and apoptosis of respiratory epithelial cells through the type I interferon signaling pathway in a mutually exclusive manner. J Virol. 2018;92(14):e00396–18.
- Van Reeth K. Cytokines in the pathogenesis of influenza. Vet Microbiol. 2000;74(1–2):109–16.
- Thiel V, Weber F. Interferon and cytokine responses to SARS-coronavirus infection. Cytokine Growth Factor Rev. 2008;19(2):121–32.
- Lau SK, Lau CC, Chan KH, Li CP, Chen H, Jin DY, et al. Delayed induction of proinflammatory cytokines and suppression of innate antiviral response by the novel Middle East respiratory syndrome coronavirus: implications for pathogenesis and treatment. J Gen Virol. 2013;94(Pt 12):2679–90.